El agua es la fuente no solo de vida sino también de todo para que una civilización progresen: La historia muestra que las civilizaciones primitivas florecieron en zonas favorables a la agricultura, como las cuencas de los ríos. Es el caso de Mesopotamia, considerada la cuna de la civilización humana, surgida en el fértil valle del Éufrates y el Tigris; y también el de Egipto, una espléndida civilización que dependía por completo del Nilo y sus periódicas crecidas. Muchas otras grandes ciudades, como Rotterdam, Londres, Montreal, París, Nueva York, Buenos Aires, Shanghái, Tokio, Chicago o Hong Kong deben su riqueza a la conexión con alguna gran vía de agua que favoreció su crecimiento y su prosperidad. Las islas que contaban con un puerto natural seguro como Singapur florecieron por la misma razón. Del mismo modo, áreas en las que el agua es muy escasa, como el norte de África o el Oriente Medio, han tenido históricamente dificultades de desarrollo. El hombre, le ha dado diferentes utilidades como por ejemplo para regadío, recreo, así como usos domésticos e industriales entre otros. El mal aprovechamiento de este recurso natural así como su uso para la vida del hombre y la naturaleza, olvidándose de que es un recurso no renovable y vital para el hombre.
Agua para beber:
necesidad del cuerpo humano El cuerpo humano está compuesto de entre un 55% y un 78% de agua, dependiendo de sus medidas y complexión. Para evitar cambios, el cuerpo necesita alrededor de siete litros diarios de agua; la cantidad exacta variará en función del nivel de actividad, la temperatura, la humedad y otros factores. La mayor parte de esta agua se absorbe con la comida o bebidas. No se ha determinado la cantidad exacta de agua que debe tomar un individuo sano, aunque una mayoría de expertos considera que unos 6-7 vasos de agua diarios (aproximadamente dos litros) es el mínimo necesario para mantener una adecuada hidratación. Una persona con los riñones en buen estado tendrá dificultades para beber demasiada agua, pero especialmente en climas cálidos y húmedos, o durante el ejercicio, beber poco también puede ser peligroso. El cuerpo humano es capaz de beber mucha más agua de la que necesita cuando se ejercita, llegando incluso a ponerse en peligro por hiperhidratación, o intoxicación de agua. Una recomendación[44] sobre consumo de agua de la Plataforma de Alimentación y Nutrición señalaba:
Una cantidad ordinaria para distintas personas es de un mililitro de agua por cada caloría de comida. La mayor parte de esta cantidad ya está contenida en los alimentos preparados"
FNB, Consejo Nacional de Investigación de los Estados Unidos, 1945
La última referencia ofrecida por este mismo organismo habla de 2.7 litros de agua diarios para una mujer y 3.7 litros para un hombre, incluyendo el consumo de agua a través de los alimentos. Naturalmente, durante el embarazo y la lactancia la mujer debe consumir más agua para mantenerse hidratada. Según el Instituto de Medicina (que recomienda una media de 2.2 litros/día para una mujer, y 3.0 litros/día para un varón) una mujer embarazada debe consumir 2.4 litros, y hasta 3 litros durante la lactancia, considerada la gran cantidad de líquido que se pierde durante la cría. También se señala que normalmente, alrededor de un 20% del agua se absorbe con la comida, mientras el resto se adquiere mediante el consumo de agua y otras bebidas. El agua se expulsa del cuerpo de muy diversas formas: a través de la orina, las heces, en forma de sudor, o en forma de vapor de agua, por exhalación del aliento. Una persona enferma, o expuesta directamente a fuentes de calor, perderá mucho más líquido, por lo que sus necesidades de consumo también aumentarán
miércoles, 29 de febrero de 2012
Distribución del agua en la tierra
El océano es el origen de la mayor parte de las precipitaciones del planeta (lluvia y nieve), pero la lluvia sobre tierra satisface casi todas las necesidades de agua dulce de las poblaciones, junto con una pequeña cantidad, aunque en aumento, de agua proveniente de la desalación. El estado del régimen hidrológico, la calidad de su agua y sus ecosistemas, están entre los factores que más contribuyen al bienestar del ser humano.
Como puede observarse en la gráfica, del total de agua que existe en el mundo, solamente el 2.5% de ella es agua potable.
- De este 2.5% mas de la mitad se encuentra en glaciares, por lo cual es inaccesible hasta ahora por su ubicación y estado, ya que el que se encuentre en icebergs impide un traslado optimo hacia las urbes.
- Poco menos un tercio de ese 2.5% se encuentra por decirlo de algún modo estancado, ya que conforman los suelos congelados.
- y finalmente, un 0,4% del 2.5% del agua potable...que es un 1% del agua total es a la cual tenemos acceso, la que se encuentra en la atmósfera. Pero pese a esto se reparte entre partículas de agua, la atmósfera, ríos, plantas y animales, y lagos.
como se puede uno dar cuenta, solo tenemos acceso a una cantidad muy infima de agua para consumo, sin pensar en la que se contamina y se pierde al ya no poder cumplir el ciclo hidrológico.
Calidad del agua
El concepto de calidad del agua es usado para describir las características químicas, físicas y biológicas del agua. La determinación de la calidad del agua depende del uso que se le va a dar. No basta con decir: "esta agua está buena," o "esta agua está mala." Agua apropiada para riego de jardines puede no ser de buena calidad para agua potable.
Se conoce al agua como disolvente universal porque tiene capacidad para disolver lentamente casi cualquier cosa con la que llegara a estar en contacto. Desde que la lluvia cae a través de la atmosfera, discurre sobre la superfie terrestre o se infiltra en ella, esta constantemente disolviendo la materia.
En la atmósfera durante la condensación y precipitación, la lluvia o la nieve absorben cantidades variables de dióxido de carbono y otros gases, así como pequeñas cantidades de material orgánico e inorgánico. Además, la precipitación arrastra sustancias radiactivas a la superficie de la Tierra.
El agua reacciona con los minerales del suelo y de las rocas. Los principales componentes disueltos en el agua superficial y subterránea son los sulfatos, los cloruros, los bicarbonatos de sodio y potasio, y los óxidos de calcio y magnesio. Las aguas de la superficie suelen contener también residuos domésticos e industriales.
Las acuiferos poco profundos pueden contener grandes cantidades de compuestos de nitrógeno y de cloruros, derivados de la agricultura intensiva, los desechos humanos y animales. Generalmente, las aguas de los pozos profundos sólo contienen minerales en disolución.
El agua del mar contiene, además de grandes cantidades de cloruro de sodio (sal), muchos otros compuestos disueltos, debido a que los océanos reciben las impurezas procedentes de ríos y arroyos. El agua pura se evapora continuamente y el porcentaje de impurezas aumenta, lo que proporciona al océano su carácter salino.
Esta es la tabla que muestra los valores permitidos en cuanto a la presencia de elementos que contiene el agua potable para el preservamiento de la flora y la fauna
Fuentes de contaminación
- Agentes patógenos.- Bacterias, virus, protozoarios, parásitos que entran al
agua provenientes de desechos orgánicos.
- Desechos que requieren oxígeno.- Los desechos orgánicos pueden ser descompuestos por bacterias que usan oxígeno
para biodegradarlos. Si haypoblaciones grandes de estas bacterias, pueden agotar el oxígeno del agua, matando así las formas devida acuáticas.
- Sustancias químicas inorgánicas.- Acidos, compuestos de metales tóxicos (Mercurio, Plomo), envenenan el agua.
- Los nutrientes vegetales pueden ocasionar el crecimiento excesivo de plantas acuáticas que después mueren y se descomponen, agotando el oxígeno del agua y de este modo causan la muerte de las especies marinas (zona muerta).
- Sustancias químicas orgánicas.- Petróleo, plásticos, plaguicidas, detergentes que amenazan la vida.
- Sedimentos o materia suspendida.- Partículas insolubles de suelo que enturbian el agua, y que son la mayor
fuente de contaminación.
- Sustancias radiactivas que pueden causar defectos congénitos y cáncer.
- Calor.- Ingresos de agua
caliente que disminuyen elcontenido de oxígeno y hace a los organismos acuáticosmuy vulnerables.
estos afectan al agua haciendo que deje de ser potable, y en ovaciones, al mismo tiempo pasa a ser un contaminante.
En países africanos donde el agua escasea muy intensamente, pese a los riesgos que implica su uso, se ven forzados a utilizar el agua sea potable o no. es por ello que una de las principales causas de muerte son las enfermedades gastrointestinales.


Las principales fuentes contaminantes que afectan al agua son:
LA IMPORTANCIA DEL AGUA
El agua es uno de los recursos naturales fundamentales y es uno de los cuatro recursos básicos en que se apoya el desarrollo, junto con el aire, la tierra y la energía.
El agua es el compuesto químico más abundante del planeta y resulta indispensable para el desarrollo de la vida. Está formado por un átomo de oxígeno y dos de hidrógeno, y su fórmula química es H2O. En la naturaleza se encuentra en estado sólido, líquido o gaseoso.
El agua pura es un recurso renovable, sin embargo puede llegar a estar tan contaminada por las actividades humanas, que ya no sea útil, sino nociva, de calidad deficiente.
La evaluación de la calidad del agua ha tenido un lento desarrollo. Hasta finales del siglo XIX no se reconoció el agua como origen de numerosas enfermedades infecciosas; sin embargo hoy en día, la importancia tanto de la cantidad como de la calidad del agua está fuera de toda duda.
La importancia que ha cobrado la calidad del agua ha permitido evidenciar que entre los factores o agentes que causan la contaminación de ella están: agentes patógenos, desechos que requieren oxígeno, sustancias químicas orgánicas e inorgánicas, nutrientes vegetales que ocasionan crecimiento excesivo de plantas acuáticas, sedimentos o material suspendido, sustancias radioactivas y el calor.
La contaminación del agua es el grado de impurificación, que puede originar efectos adversos a la salud de un número representativo de personas durante períodos previsibles de tiempo.
Se considera que el agua está contaminada, cuando ya no puede utilizarse para el uso que se le iba a dar, en su estado natural o cuando se ven alteradas sus propiedades químicas, físicas, biológicas y/o su composición. En líneas generales, el agua está contaminada cuando pierde su potabilidad para consumo diario o para su utilización en actividades domésticas, industriales o agrícolas.
Para evitar las consecuencias del uso del agua contaminada se han ideado mecanismos de control temprano de la contaminación. Existen normas que establecen los rangos permisibles de contaminación, que buscan asegurar que el agua que se utiliza no sea dañina. Cada país debe tener una institución que se encargue de dicho control. En Estados Unidos existen parámetros mencionados en la Farmacopea de los Estados Unidos(USP) que norman en relación a las especificaciones de todo tipoen el agua potable, en el área microbiológica se toman en cuenta niveles de alerta y niveles de acción.
A pesar del control y prevención que se persigue en muchos países, se reportan aguas contaminadas con coliformes lo que hace que la calidad del agua no sea la deseada, si bien muchos países tienen agua en grandes cantidades, el aumento poblacional, la contaminación de las industrias, el uso excesivo de agroquímicos, la falta de tratamiento de aguas negras y la erosión de suelos por la deforestación hacen que ese recurso sea escaso. En Guatemala cada año se producen 380 millones de metros cúbicos de aguas negras y de ellos, sólo 19 millones son tratados. El resto llega con toda su carga contaminante a los ríos y lagos.
La provisión de agua dulce está disminuyendo a nivel mundial, 1200 millones de habitantes no tienen acceso a una fuente de agua potable segura. Las enfermedades por aguas contaminadas matan más de 4 millones de niños al año y 20% de todas las especies acuáticas de agua fresca están extintas o en peligro de desaparecer.
El agua es el compuesto químico más abundante del planeta y resulta indispensable para el desarrollo de la vida. Está formado por un átomo de oxígeno y dos de hidrógeno, y su fórmula química es H2O. En la naturaleza se encuentra en estado sólido, líquido o gaseoso.
El agua pura es un recurso renovable, sin embargo puede llegar a estar tan contaminada por las actividades humanas, que ya no sea útil, sino nociva, de calidad deficiente.
La evaluación de la calidad del agua ha tenido un lento desarrollo. Hasta finales del siglo XIX no se reconoció el agua como origen de numerosas enfermedades infecciosas; sin embargo hoy en día, la importancia tanto de la cantidad como de la calidad del agua está fuera de toda duda.
La importancia que ha cobrado la calidad del agua ha permitido evidenciar que entre los factores o agentes que causan la contaminación de ella están: agentes patógenos, desechos que requieren oxígeno, sustancias químicas orgánicas e inorgánicas, nutrientes vegetales que ocasionan crecimiento excesivo de plantas acuáticas, sedimentos o material suspendido, sustancias radioactivas y el calor.
La contaminación del agua es el grado de impurificación, que puede originar efectos adversos a la salud de un número representativo de personas durante períodos previsibles de tiempo.
Se considera que el agua está contaminada, cuando ya no puede utilizarse para el uso que se le iba a dar, en su estado natural o cuando se ven alteradas sus propiedades químicas, físicas, biológicas y/o su composición. En líneas generales, el agua está contaminada cuando pierde su potabilidad para consumo diario o para su utilización en actividades domésticas, industriales o agrícolas.
Para evitar las consecuencias del uso del agua contaminada se han ideado mecanismos de control temprano de la contaminación. Existen normas que establecen los rangos permisibles de contaminación, que buscan asegurar que el agua que se utiliza no sea dañina. Cada país debe tener una institución que se encargue de dicho control. En Estados Unidos existen parámetros mencionados en la Farmacopea de los Estados Unidos(USP) que norman en relación a las especificaciones de todo tipoen el agua potable, en el área microbiológica se toman en cuenta niveles de alerta y niveles de acción.
A pesar del control y prevención que se persigue en muchos países, se reportan aguas contaminadas con coliformes lo que hace que la calidad del agua no sea la deseada, si bien muchos países tienen agua en grandes cantidades, el aumento poblacional, la contaminación de las industrias, el uso excesivo de agroquímicos, la falta de tratamiento de aguas negras y la erosión de suelos por la deforestación hacen que ese recurso sea escaso. En Guatemala cada año se producen 380 millones de metros cúbicos de aguas negras y de ellos, sólo 19 millones son tratados. El resto llega con toda su carga contaminante a los ríos y lagos.
La provisión de agua dulce está disminuyendo a nivel mundial, 1200 millones de habitantes no tienen acceso a una fuente de agua potable segura. Las enfermedades por aguas contaminadas matan más de 4 millones de niños al año y 20% de todas las especies acuáticas de agua fresca están extintas o en peligro de desaparecer.
Agua para la agricultura, la industria y la comunidad.
Las plantas son la forma de vida, a nivel macroscopico, más auto auto-suficiente que existe en el planeta, generan alimento a partir de agua, luz y nutrientes que toman del suelo, los cuales pasan a formar parte de su composición en frutos que producen o en las células que los integran.
Cada año las plantas generan una cantidad enorme de alimento, que es aprovechado, por insectos, hongos y animales. Entre estos últimos se encuentra la especie humana, la cual posee una dieta omnivora y toma muchos nutrientes de la ingesta de plantas.
la vida es sostenible por la ingesta de plantas, y la continua producción de estas viene por los trabajos agrícolas que se realizan, los cuales serian imposibles sin el agua que nutre y da vida a los cultivos.
En la industria el agua es de las principales fuentes generadoras de energia. las centrales Hidroeléctricas general suficiente energía como para mantener pequeños estados y localidades de una manera muy limpia y eficiente. sumado a esto, en muchos lugares y fuentes de trabajo aun se ocupan maquinas de vapor que son básicas para el funcionamiento industrial como se da el caso en el lavado a presión. otro uso esta en las industrias papeleras que usan el agua para transportar materiales por medio de canales. estos son algunos de los usos que se le da, indistrualmente, al agua.

El uso en comunidad es del que mayor conocimiento tenemos, basta con despertarse un día y contar las veces que no-usamos agua para darnos cuenta de la importancia en uso que se le da, la usamos para cocinar, para bañarnos, para desinfectarnos, lavarnos los dientes, etc.
Cada año las plantas generan una cantidad enorme de alimento, que es aprovechado, por insectos, hongos y animales. Entre estos últimos se encuentra la especie humana, la cual posee una dieta omnivora y toma muchos nutrientes de la ingesta de plantas.
la vida es sostenible por la ingesta de plantas, y la continua producción de estas viene por los trabajos agrícolas que se realizan, los cuales serian imposibles sin el agua que nutre y da vida a los cultivos.
En la industria el agua es de las principales fuentes generadoras de energia. las centrales Hidroeléctricas general suficiente energía como para mantener pequeños estados y localidades de una manera muy limpia y eficiente. sumado a esto, en muchos lugares y fuentes de trabajo aun se ocupan maquinas de vapor que son básicas para el funcionamiento industrial como se da el caso en el lavado a presión. otro uso esta en las industrias papeleras que usan el agua para transportar materiales por medio de canales. estos son algunos de los usos que se le da, indistrualmente, al agua.

El uso en comunidad es del que mayor conocimiento tenemos, basta con despertarse un día y contar las veces que no-usamos agua para darnos cuenta de la importancia en uso que se le da, la usamos para cocinar, para bañarnos, para desinfectarnos, lavarnos los dientes, etc.
Purificación del agua
En algunas ocasiones, aun a pesar de poseer impurezas y haber sido contaminada, el agua puede volver a un estado potable. Para conseguir esto hay diversos métodos, alguno que otro mas o menos común que otro. los mas comunes y sencillos son los siguientes.
Existen diferentes formas de purificar el agua, la forma mas popular de obtener agua pura eshervirla. El hervir el agua durante al menos cinco minutos bastara para matar a todos los organismos que causan enfermedades. Sin embargo, hervir el agua no es fácil. Usa mucho combustible que es a menudo caro o difícil de encontrar. Este proceso cambia el sabor del agua y necesita un tiempo para enfriarse antes de que pueda beberse. Existen otras formas para purificar el agua, las más utilizadas son:
Desinfección solar (método SODIS)
Una forma de desinfectar el agua de drenaje es el uso de radiación UV. La radiación ultra violeta es un proceso demostrado para la desinfección del agua, aire y superficies sólidas contaminadas microbiológicamente .
Este método se está haciendo muy popular porque es barato, simple, y requiere poco trabajo. La investigación ha demostrado que si se usa correctamente, el agua tratada es tan limpia como el agua hervida.
El proceso se llama desinfección solar. Este método requiere botellas de plástico transparentes de aproximadamente 1,5 litros (las de agua embotellada son ideales) y que el agua que no esté demasiado turbia.
Es importante no usar botellas de vidrio, ya que no permiten que entre suficiente luz solar en el agua. Las botellas de plástico tienen costados muy finos que permiten que la luz solar llegue al agua. El agua turbia debe dejarse decantar antes del uso y debe filtrarse mediante una tela ofiltro de arena si todavía está turbia.
El metodo
Llenar una botella limpia aproximadamente tres cuartos de su capacidad, taparla y agitarla vigorosamente durante aproximadamente 20 segundos. Esto asegura que haya suficiente aire en el agua, el que reacciona con la luz del sol para ayudar al proceso de purificación.
Llenar luego la botella hasta el tope y ponerla acostada en un lugar donde reciba luz solar directa durante varias horas y donde el viento no enfríe la botella. Un tejado es ideal si está hecho de planchas metálicas, tejas o concreto.
La técnica SODIS puede ser practicada por personas que no tienen acceso al agua potable en cualquier lugar del mundo. Es un método muy sencillo de aplicar por las siguientes razones:
- El método se puede utilizar a nivel doméstico.
- Sólo depende de la radiación solar y de las botellas de plástico.
- El coste de utilizar y mantener la tecnología de SODIS es prácticamente nulo.
Desinfección por calor
Cuando se aplica un tratamiento por calor, una solución se calienta durante 30 segundos a una temperatura de 95 grados centígrados. Esta temperatura es suficiente para matar a todos los agentes patógenos. Una desventaja del tratamiento por calor es el consumo de gas.
Filtración lenta por arena
Durante muchos años los agricultores comerciales han usado la técnica llamada "filtración lenta por arena" . Este procedimiento se usa frecuentemente como un método muy eficaz para eliminar los sólidos suspendidos en el agua. El mecanismo de filtración se compone de una serie de estratos de arena con una variedad de tamaños de grano y de gravedad específica. Los filtros de arena se pueden obtener en diferentes tamaños y materiales tanto manuales como de funcionamiento automático.
Las impurezas suspendidas y disueltas en el agua natural impiden que ésta sea adecuada para numerosos fines. Los materiales indeseables, orgánicos e inorgánicos, se extraen por métodos de criba y sedimentación que eliminan los materiales suspendidos. Otro método es el tratamiento con ciertos compuestos, como el carbón activado, que eliminan los sabores y olores desagradables. También se puede purificar el agua por filtración, o por cloración o irradiación que matan los microorganismos infecciosos.
En la ventilación o saturación de agua con aire, se hace entrar el agua en contacto con el aire de forma que se produzca la máxima difusión; esto se lleva a cabo normalmente en fuentes, esparciendo agua en el aire. La ventilación elimina los olores y sabores producidos por la descomposición de la materia orgánica, al igual que los desechos industriales como los fenoles, y gases volátiles como el cloro. También convierte los compuestos de hierro y manganeso disueltos en óxidos hidratados insolubles que luego pueden ser extraídos con facilidad.
La dureza de las aguas naturales es producida sobre todo por las sales de calcio y magnesio, y en menor proporción por el hierro, el aluminio y otros metales. La que se debe a los bicarbonatos y carbonatos de calcio y magnesio se denomina dureza temporal y puede eliminarse por ebullición, que al mismo tiempo esteriliza el agua. La dureza residual se conoce como dureza no carbónica o permanente . Las aguas que poseen esta dureza pueden ablandarse añadiendo carbonato de sodio y cal, o filtrándolas a través de ceolitas naturales o artificiales que absorben los iones metálicos que producen la dureza, y liberan iones sodio en el agua. Los detergentes contienen ciertos agentes separadores que inactivan las sustancias causantes de la dureza del agua.
El hierro, que produce un sabor desagradable en el agua potable, puede extraerse por medio de la ventilación y sedimentación, o pasando el agua a través de filtros de ceolita. También se puede estabilizar el hierro añadiendo ciertas sales, como los polifosfatos. El agua que se utiliza en los laboratorios, se destila o se desmineraliza pasándola a través de compuestos que absorben los iones.

jueves, 23 de febrero de 2012
El por qué de las maravillas del agua
 el agua es un elemento crítico para la proliferación de la vida. El agua desempeña este papel permitiendo a los compuestos orgánicos diversas reacciones que, en último término, posibilitan la replicación de ADN. De un modo u otro, todas las formas de vida conocidas dependen del agua. Sus propiedades la convierten en un activo agente, esencial en muchos de los procesos metabólicos que los seres vivos realizan. Es esencial para la supervivencia de todas las formas conocidas de vida, el agua es esencial para la mayoría de las formas de vida conocidas por el hombre, incluida la humana.
el agua es un elemento crítico para la proliferación de la vida. El agua desempeña este papel permitiendo a los compuestos orgánicos diversas reacciones que, en último término, posibilitan la replicación de ADN. De un modo u otro, todas las formas de vida conocidas dependen del agua. Sus propiedades la convierten en un activo agente, esencial en muchos de los procesos metabólicos que los seres vivos realizan. Es esencial para la supervivencia de todas las formas conocidas de vida, el agua es esencial para la mayoría de las formas de vida conocidas por el hombre, incluida la humana. Desde esta perspectiva metabólica, podemos distinguir dos tipos de funciones del agua: anabólicamente, la extracción de agua de moléculas (mediante reacciones químicas enzimáticas que consumen energía) permite el crecimiento de moléculas mayores, como los triglicéridos o las proteínas; en cuanto al catabolismo, el agua actúa como un disolvente de los enlaces entre átomos, reduciendo el tamaño de las moléculas (como glucosas, ácidos grasos y aminoácidos), suministrando energía en el proceso. El agua es por tanto un medio irremplazable a nivel molecular para numerosos organismos vivos. Estos procesos metabólicos no podrían realizarse en un entorno sin agua, por lo que algunos científicos se han planteado la hipótesis de qué tipo de mecanismos como laabsorción de gas, asimilación de minerales, podrían mantener la vida sobre el planeta.
 Es un compuesto esencial para la fotosíntesis y la respiración. Las células fotosintéticas utilizan la energía del sol para dividir el oxígeno y el hidrógeno presentes en la molécula de agua. El hidrógeno es combinado entonces con CO2 (absorbido del aire o del agua) para formar glucosa, liberando oxígeno en el proceso. Todas las células vivas utilizan algún tipo de "combustible" en el proceso de oxidación del hidrógeno y carbono para capturar la energía solar y procesar el agua y el CO2. Este proceso se denomina respiración celular.
Es un compuesto esencial para la fotosíntesis y la respiración. Las células fotosintéticas utilizan la energía del sol para dividir el oxígeno y el hidrógeno presentes en la molécula de agua. El hidrógeno es combinado entonces con CO2 (absorbido del aire o del agua) para formar glucosa, liberando oxígeno en el proceso. Todas las células vivas utilizan algún tipo de "combustible" en el proceso de oxidación del hidrógeno y carbono para capturar la energía solar y procesar el agua y el CO2. Este proceso se denomina respiración celular.
El agua es fundamental para todas las formas de vida conocida. Los humanos consumen agua potable. Los recursos naturales se han vuelto escasos con la creciente población mundial y su disposición en varias regiones habitadas es la preocupación de muchas organizaciones gubernamentales.
El total del agua presente en el planeta, en todas sus formas, se denomina hidrosfera. El agua cubre 3/4 partes (71%) de la superficie de la Tierra.
El cuerpo humano está compuesto de entre un 55% y un 78% de agua, dependiendo de sus medidas y complexión. Para evitar desórdenes, el cuerpo necesita alrededor de siete litros diarios de agua; la cantidad exacta variará en función del nivel de actividad, la temperatura, la humedad y otros factores. La mayor parte de esta agua se absorbe con la comida o bebidas. No se ha determinado la cantidad exacta de agua que debe tomar un individuo sano, aunque una mayoría de expertos considera que unos 6-7 vasos de agua diarios.
Estructura y propiedades de los líquidos. Modelo cinético molecular de los líquidos.
El agua es un líquido incoloro, inodoro e insípido que está compuesto por dos átomos de hidrógeno y uno de oxígeno (H2O).
A la presión atmosférica normal (760 mm de mercurio), el punto de congelación del agua es a los 0 °C y su punto de ebullición, a los 100 °C. El agua alcanza su densidad máxima a una temperatura de 4 °C y se expande al congelarse. Sus propiedades físicas se utilizan como patrones para definir, por ejemplo, escalas de temperatura. El agua es uno de los agentes ionizantes más conocidos.
Puesto que todas las sustancias son de alguna manera solubles en agua, se le conoce frecuentemente como el disolvente universal. El agua se combina con ciertas sales para formar hidratos, reacciona con los óxidos de los metales formando ácidos y actúa como catalizador en muchas reacciones químicas importantes.
MODELO CINÉTICO MOLECULAR.
En el ESTADO LIQUIDO las moléculas están más separadas y se mueven de manera que pueden cambiar sus posiciones, pero las fuerzas de cohesión, aunque son manos intensas que en el estado sólido, impiden que las moléculas puedan independizarse.
Propiedades de los liquidos
FORMA: Adoptan la forma del recipiente que los contiene.
VOLUMEN: No varía.
COMPRESIBILIDAD: Son incompresibles.
FUERZAS INTERMOLECULARES: En un líquido las fuerzas intermoleculares de ATRACCIÓN y REPULSIÓN se encuentran igualadas.
Un líquido es una sustancia formada por moléculas que están en constante movimiento de desplazamiento y que se deslizan unas sobre las otras.
La disposición de estas moléculas le da un aspecto de fluidez con la que frecuentemente se les asocia.
Los líquidos son fluidos porque no tienen forma propia, sino que adoptan la forma del recipiente que los contiene.
FORMA: Adoptan la forma del recipiente que los contiene.
VOLUMEN: No varía.
COMPRESIBILIDAD: Son incompresibles.
FUERZAS INTERMOLECULARES: En un líquido las fuerzas intermoleculares de ATRACCIÓN y REPULSIÓN se encuentran igualadas.
Un líquido es una sustancia formada por moléculas que están en constante movimiento de desplazamiento y que se deslizan unas sobre las otras.
La disposición de estas moléculas le da un aspecto de fluidez con la que frecuentemente se les asocia.
Los líquidos son fluidos porque no tienen forma propia, sino que adoptan la forma del recipiente que los contiene.
¿Por qué los líquidos son incompresibles?
Los líquidos son incompresibles porque las moléculas que los constituyen están tan unidas que no pueden acercarse más; sólo pueden deslizarse las unas sobre las otras.
Los líquidos, AL igual que los sólidos, presentan propiedades específicas entre las cuales señalaremos:
• Volatilidad: Es decir, facilidad para evaporarse.
Los líquidos son incompresibles porque las moléculas que los constituyen están tan unidas que no pueden acercarse más; sólo pueden deslizarse las unas sobre las otras.
Los líquidos, AL igual que los sólidos, presentan propiedades específicas entre las cuales señalaremos:
• Volatilidad: Es decir, facilidad para evaporarse.
• Viscosidad: Es decir, dificultad al escurrimiento.
miércoles, 22 de febrero de 2012
Propiedades del agua: Puntos de fusión ebullición. Densidad. Capacidad calorífica. Calores latentes de fusión y de evaporación. Tensión superficial. Poder disolvente.
El agua es un líquido inodoro e insípido. Tiene un cierto color azul cuando se concentra en grandes masas.
A la presión atmosférica (760 mm de mercurio), el punto de fusión del agua pura es de 0ºC y el punto de ebullición es de 100ºC, cristaliza en el sistema hexagonal, llamándose nieve o hielo según se presente de forma esponjosa o compacta, se expande al congelarse, es decir aumenta de volumen, de ahí que la densidad del hielo sea menor que la del agua y por ello el hielo flota en el agua líquida. El agua alcanza su densidad máxima a una temperatura de 4ºC,que es de 1g/cc.
Su capacidad calorífica es superior a la de cualquier otro líquido o sólido, siendo su calor específico de 1 cal/g, esto significa que una masa de agua puede absorber o desprender grandes cantidades de calor, sin experimentar apenas cambios de temperatura, lo que tiene gran influencia en el clima (las grandes masas de agua de los océanos tardan más tiempo en calentarse y enfriarse que el suelo terrestre). Sus calores latentes de vaporización y de fusión (540 y 80 cal/g, respectivamente) son también excepcionalmente elevados.
Su capacidad calorífica es superior a la de cualquier otro líquido o sólido, siendo su calor específico de 1 cal/g, esto significa que una masa de agua puede absorber o desprender grandes cantidades de calor, sin experimentar apenas cambios de temperatura, lo que tiene gran influencia en el clima (las grandes masas de agua de los océanos tardan más tiempo en calentarse y enfriarse que el suelo terrestre). Sus calores latentes de vaporización y de fusión (540 y 80 cal/g, respectivamente) son también excepcionalmente elevados.
En física se denomina tensión superficial de un líquido a la cantidad de energía necesaria para aumentar su superficie por unidad de área. Esta definición implica que el líquido tiene una resistencia para aumentar su superficie. En el caso del agua y otros líquidos, este efecto permite a algunos insectos, como el zapatero desplazarse por la superficie del agua sin hundirse. La tensión superficial (una manifestación de las fuerzas intermoleculares en los líquidos), junto a las fuerzas que se dan entre los líquidos y las superficies sólidas que entran en contacto con ellos, da lugar a la capilaridad y tiende a contraer dicha superficie.
El agua es el líquido que más sustancias disuelve, por eso decimos que es el disolvente universal. Esta propiedad, tal vez la más importante para la vida, se debe a su capacidad para formar puentes de hidrógeno.
En el caso de las disoluciones iónicas los iones de las sales son atraídos por los dipolos del agua, quedando "atrapados" y recubiertos de moléculas de agua en forma de iones hidratados o solvatados.
La capacidad disolvente es la responsable de que sea el medio donde ocurren las reacciones del metabolismo.
La estructura de la molécula de agua la hace capaz de actuar como un disolvente poderoso de muchas sustancias. Si se introduce un cristal de cloruro de sodio en agua, las moléculas de agua rodean a los iones de sodio y cloro, atrayéndolos por sus extremos negativos o positivos, respectivamente.
El movimiento de las moléculas de agua arrastra a los iones que se dispersan por ella, formando una disolución de cloruro de sodio en agua. Ello hace que en la naturaleza exista un enorme número de disoluciones acuosas.
Composición del agua: electrólisis y síntesis.
Electrolisis: Consiste en la descomposición mediante una corriente eléctrica de sustancias ionizadas denominadas electrolitos. La palabra electrólisis procede de dos radicales, electro que hace referencia a electricidad y lisis que quiere decir ruptura.
La electrólisis del agua nos permite:
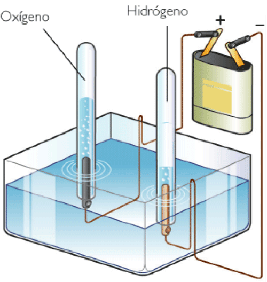
Comprobar que el agua es un compuesto de hidrógeno y oxígeno.
Ver la relación en la que se encuentran estos gases: 2 volúmenes de hidrogeno por 1 de oxígeno. ¡Lafamosa H2O!
Comprender la diferencia entre reacciones endotérmicas y exotérmicas.
La electrólisis del agua nos permite:

Comprobar que el agua es un compuesto de hidrógeno y oxígeno.
Ver la relación en la que se encuentran estos gases: 2 volúmenes de hidrogeno por 1 de oxígeno. ¡Lafamosa H2O!
Comprender la diferencia entre reacciones endotérmicas y exotérmicas.
.jpg)
La sintesis del agua es lo inverso a la electrolisis y esta parte del hidrógeno y oxígeno mediante una chispa eléctrica.
Estructura molecular del agua: Enlaces covalentes. Moléculas polares y no polares. Puentes de hidrógeno.
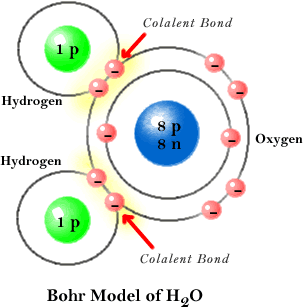 Los enlaces covalentes se producen por compartición de electrones entre dos o mas átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
Los enlaces covalentes se producen por compartición de electrones entre dos o mas átomos. Este tipo de enlace se produce cuando existe electronegatividad polar pero la diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
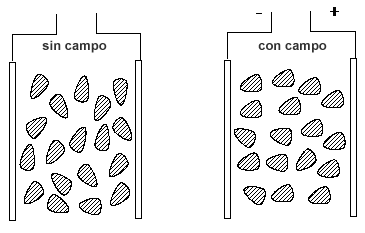
La polaridad es una propiedad de las moléculas que representa la separación de las cargas eléctricas en la misma. Esta propiedad está íntimamente relacionada con otras propiedades como la solubilidad, punto de fusión,punto de ebullición, fuerzas intermoleculares, etc.
Al formarse una molécula de modo covalente el par de electrones tiende a desplazarse hacia el átomo que tiene mayor electronegatividad. Esto origina una densidad de cargadesigual entre los núcleos que forman el enlace (se forma un dipolo eléctrico). El enlace es más polar cuanto mayor sea la diferencia entre las electronegatividades de los átomos que se enlazan; así pues, dos átomos iguales atraerán al par de electrones covalente con la misma fuerza (establecida por la Ley de Coulomb) y los electrones permanecerán en el centro haciendo que el enlace sea apolar.Pero un enlace polar no requiere siempre una molécula polar; para averiguar si una molécula es polar hay que atender a la cantidad de enlaces polares y la estructura de la molécula.
Las moléculas apolares son aquellas moléculas que se producen por la unión entre átomos que poseen igual electronegatividad, por lo que las fuerzas con las que los átomos que conforman la molécula atraen los electrones del enlace son iguales, produciéndose así la anulación de dichas fuerzas. Un ejemplo de una molécula apolar es la molécula de Oxígeno (O2). En esta molécula cada átomo de Oxígeno atrae a los electrones compartidos hacia sí mismo con una misma intensidad pero en sentidos opuestos, por lo que se anulan las fuerzas de atracción y la molécula no se convierte en un dipolo.
Regulación del clima.
 En la regulación del clima global participan todos los sistemas de la naturaleza: la atmósfera y la hidrosfera (sobre todo los océanos), la criosfera (hielo, nieve), la litosfera (la corteza terrestre) y la biosfera. En las últimas décadas, también el ser humano (como causante del aumento en la emisión de gases de efecto invernadero, como el dióxido de carbono y el metano) se ha convertido en un factor que afecta al clima.
En la regulación del clima global participan todos los sistemas de la naturaleza: la atmósfera y la hidrosfera (sobre todo los océanos), la criosfera (hielo, nieve), la litosfera (la corteza terrestre) y la biosfera. En las últimas décadas, también el ser humano (como causante del aumento en la emisión de gases de efecto invernadero, como el dióxido de carbono y el metano) se ha convertido en un factor que afecta al clima.En el sistema climático de la Tierra, el mar cumple una función primordial. La elevada capacidad calórica del agua marina y las particularidades de su balance térmico, como la mezcla de las capas superiores, amortiguan las diferencias de temperatura a lo largo del año. Tanto el sistema de circulación general de la atmósfera como el de los océanos contribuyen, en proporciones similares, al equilibrio térmico entre las latitudes altas y bajas.
Además, los océanos influyen sobre el clima no sólo térmicamente, sino también como parte de los grandes ciclos biogeoquímicos, especialmente el ciclo del carbono que, en forma de dióxido de carbono, es fundamental para la futura evolución del clima. Quien quiera saber hoy cómo será el clima mañana, no puede ignorar los océanos.
Aunque sobre los hielos antárticos se hayan llegado a medir temperaturas inferiores a –90° C, la temperatura media de la superficie terrestre se sitúa en unos agradables 15° C. Debemos agradecer este entorno templado al efecto invernadero natural que contribuye a retener en la atmósfera la radiación térmica emitida por la superficie de la Tierra. Sin dicho efecto natural, la temperatura media sería unos 33° C más baja.
Soluciones. Concentración en por ciento y molar
En química una disolución o solución es una mezcla homogénea de dos o más sustancias. A la sustancia disuelta se le llama soluto y a la sustancia donde se disuelve se le llama solvente. Una solución acuosa es aquella donde el solvente es el agua. Puesto que el agua es una excelente solvente así como naturalmente abundante, se ha convertido en lógicamente un solvente muy usado adentro química.
El disolvente es una sustancia que permite la dispersión de otra en su seno. Es el medio dispersante de la disolución. Normalmente, el disolvente establece el estado físico de la disolución, por lo que se dice que el disolvente es el componente de una disolución que está en el mismo estado físico que la disolución. También es el componente de la mezcla que se encuentra en mayor proporción.
La capacidad de una sustancia de disolver en agua se determina cerca si la sustancia puede emparejar o exceder el fuerte fuerzas atractivas las moléculas de esa agua generan entre sí mismos. Si la sustancia carece la capacidad de disolver en agua las moléculas forman a precipitado.
Al realizar cálculos con respecto el reaccionar de unas o más soluciones acuosas, una debe saber generalmente concentración, o molaridad, de las soluciones acuosas. La concentración de la solución se da en términos de forma del soluto antes de ella que disuelve.
Lo más habitual es que se trate de un sólido que es contenido en una solución líquida (sin que se forme una segunda fase)
Solubilidad acuosa
Éstas son pautas simples para determinarse solubilidad.
- Todos los compuestos con el Na+, K+, NH4+ los iones son solubles en agua.
- Todos los nitratos (NO3-) y acetatos (CH3COO-) sea soluble en agua.
- La mayoría de los cloruros (Cl-) y sulfatos (TAN42-) sea soluble en agua. Excepto el siguiente: AgCl, PbCl2, Hectogramo2Cl2, BaSO4, PbSO4 y CaSO4.
- La mayoría de los carbonatos (CO32-), fosfatos (PO43-), sulfuros (S2-), e hidróxidos (OH-) sea insoluble en agua. Las excepciones son LiOH, NaOH, KOH y NH3 (aq).
Concentración en por ciento y Molar
La molaridad (M) es el número de moles de soluto por litro de disolución. Por ejemplo, si se disuelven 0,5 moles de soluto en 100 mL de disolución, se tiene una concentración de ese soluto de 5,0 M (5,0 molar). Para preparar una disolución de esta concentración normalmente se disuelve primero el soluto en un volumen menor, por ejemplo 30 mL, y se traslada esa disolución a un matraz aforado, para después rellenarlo con más disolvente hasta los 100 mL.
La concentración de una solución es la medida de la cantidad de soluto presente en una cantidad de solución (o disolvente). Existen varias maneras de describir la concentración de una solución.
Unidades Físicas. PorcentajesPor definición el porcentaje es la proporción (en partes) por cada 100 partes de un todo.
Si aplicamos este concepto a las disoluciones podemos definir la concentración de una solución como partes de soluto en 100 partes de solución. Las “partes” puedes ser expresadas en Masa (g) o volúmenes (mL, L).
Si se disuelven 2 g de NaCl en 98 g de Agua se obtienen 100 g de una solución que es 2 por ciento (%) de masa (sal). Específicamente esta solución se describiría como 2 % (peso/peso) de sal en agua [lo cual quiere decir que son 2 g (peso) en 100 g (peso) de solución)]
Si una solucion tiene 5 L metanol (volumen) en un volumen total de 100 L tendremos una solución 5% (volumen/volumen ó vol./vol.)
Otra posibilidad es expresar el peso de soluto en 100 volúmenes de solución. Así una solución de 0,5 g (peso) en 100 mL (volumen) de solución sería una solución 0,5% (peso/volumen ó P/V)
¿Como calcular porcentajes?
Regla de tres para calcular proporciones
La regla de tres es frecuentemente usada para calcular concentraciones ya que hay una relación proporcional entre el soluto, el solvente y la disolución y entre los porcentajes de cada uno de ellos.
La regla de tres se puede dar en tres casos:
- entre el soluto y el disolvente.
- entre el soluto y la disolución.
- entre el disolvente y la disolución.
Hay que tomar en cuenta que el porcentaje de la disolución es siempre el 100%.
Abajo se presentan las tres posibilidades en que podemos usar la regla de tres para solucionar problemas de concentración. En cada caso, si se tienen tres valores podemos calcular el cuarto:
Regla de tres entre el soluto y el disolvente
| Ejemplo: Supongamos que no tenemos los gramos del disolvente. Para calcularlo, usamos la regla de tres:
|
Regla de tres entre el soluto y la disolución
| Ejemplo: Supongamos que no tenemos el porcentaje del soluto. Para calcularlo, usamos la regla de tres:
|
Regla de tres entre el disolvente y la disolución
| Ejemplo: Supongamos que no tenemos los gramos de la disolución. Para calcularlo, usamos la regla de tres:
|
Ejemplos
Manejando las reglas de tres y la fórmula de Disolución = disolvente + soluto, se pueden resolver una gran variedad de problemas de concentración con porcentajes masa-masa y volumen-volumen.
Los procedimientos para los cálculos con porcentajes volumen-volumen son exactamente iguales a los de masa-masa, excepto que en lugar de trabajar con unidades de masa como los gramos, se usan unidades de volumen, como el cm3.
Ejemplo 1
Se tienen 250 gramos de agua y se quiere hacer una disolución de bicarbonato de sodio al 8%. ¿Cuántos gramos de bicarbonato de sodio se necesitan?, ¿cuantos gramos de de disolución se producirán?, ¿cuál es el porcentaje del disolvente?
Datos:
soluto ?? g 8% disolvente 250 g ??% disolución ?? g 100%
Calculo el porcentaje del disolvente:
- Disolución = soluto + disolvente --> Disolvente = disolución - soluto
- El porcentaje del disolvente es 92% = 100% - 8%
soluto ?? g 8% disolvente 250 g 92% disolución ?? g 100%
Ahora tengo los gramos del disolvente y también su concentración, sus datos están "completos" (hay una pareja "masa-porcentaje"), así que puedo usarlo como base para calcular tanto la masa del soluto como la masa de la disolución. Con la regla de tres ente el soluto y el disolvente se puede calcular la masa del soluto, y con la regla de tres entre el disolvente y la disolución se puede calcular la masa de la disolución.
Usaremos la regla de tres entre el soluto y el disolvente para obtener los gramos del soluto:
- Si X gramos de soluto son el 8%, y 250 gramos de disolvente son el 92%, ¿cuantos gramos tiene el soluto?
- El soluto tiene 21,74 g = 250 g x 8 / 92
soluto 21,74 g 8% disolvente 250 g 92% disolución ?? g 100%
Los gramos de la disolución los podemos encontrar de tres maneras: con la regla de tres entre el soluto y la disolución, con la regla de tres entre el disolvente y la disolución, o sumando la disolución y el disolvente. Se usará esta última.
Sumo el soluto y el disolvente para obtener los gramos de la disolución:
- Disolución = soluto + disolvente
- Los gramos disolución son 271,74 g = 21,74 g + 250 g
soluto 21,74 g 8% disolvente 250 g 92% disolución 271,74 g 100%
]Ejemplo 2
Se mezclan dos disoluciones de cloruro de sodio. La primera son 120 gramos de disolución al 10%, la segunda son 240 gramos al 8%. ¿Cuál es la concentración la disolución resultante?, ¿cuántos gramos de agua y cloruro de sodio tiene?
En este ejemplo tenemos tres disoluciones. Las dos primeras son mezcladas para dar una tercera. La cantidad de agua y cloruro de sodio de la tercera es la suma del agua y del cloruro de sodio de las dos primeras (ley de conservación de la masa). Por lo tanto, debemos calcular la cantidad de estas sustancias en las dos primeras disoluciones para luego sumarlas y obtener las cantidades que conforman la tercera disolución, y por último calcular el porcentaje de concentración de la tercera.
| Primera disolución | Segunda disolución | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
120 gramos de disolución al 10%
Usamos la regla de tres entre el soluto y la disolución para saber la masa del soluto:
Calculamos los gramos de disolvente:
|
240 gramos de disolución al 8%
Usamos la regla de tres entre el soluto y la disolución para saber la masa del soluto:
Calculamos los gramos de disolvente:
|
Tercera disolución
Ahora mezclamos la primera y la segunda disolución para formar la tercera, es decir, sumamos los solutos, los disolventes y las disoluciones:
- soluto: 31,2 g = 12 g + 19,2 g
- disolvente: 328,8 g = 108 g + 220,8 g
- disolución: 360 g = 120 g + 240 g
soluto 31,2 g ??% disolvente 328,8 g disolución 360 g 100%
Por último, usamos una regla de tres entre el soluto y la disolución para saber la concentración:
Concentración: 8,66% = 31,2 g × 100 / 360 g
soluto 31,2 g 8,66% disolvente 328,8g disolución 360 g 100%
Si quisiéramos saber el porcentaje del disolvente, podríamos encontrarlo de tres maneras:
| disolvente = Disolución - soluto | Por regla de tres entre el soluto y el disolvente | Por regla de tres entre la disolución y el disolvente | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 91,34 = 100 - 8.66 | 91,26 = 328.8 g × 8.66 / 31,2 g | 91,33 = 328.8 g × 100 / 360 g | |||||||||||||||||||||||||||
|
|
|
Nota: Los tres resultados son ligeramente diferentes por errores de redondeo en los cálculos de masa y porcentaje anteriores.
Suscribirse a:
Entradas (Atom)